|
|
|
|

| Op vele manieren is een indeling te maken van alle deeltjes:
| ||
| fundamenteel | of | samengesteld |
| materiedeeltje | of | krachtdrager |
| met massa | of | zonder massa |
| elektrisch geladen | of | neutraal |
| met kleurlading | of | kleurloos |
| met spin 0, 1, 2, .. | of | met spin 1/2, 3/2, .. |
De laatste is wel de vreemdste, maar: het blijkt van belang of de spin een geheel getal is of niet. | ||
Uitsluitingsprincipe van PauliVoor elektronen in een atoom zijn er twee mogelijkheden: gelijk, of niet. We spreken van 'spin up' en 'spin down'. Nu zegt het uitsluitingsprincipe van Pauli: in één systeem kunnen twee deeltjes niet in dezelfde toestand zijn. Toepassing van deze regel op een atoom geeft bijvoorbeeld: de twee elektronen in een helium-atoom hebben verschillende spin. En: verschillende energie geeft de 'schillen' in een groter atoom. Eerst werd gedacht dat alle elementaire deeltjes zich zo zouden gedragen, maar gebleken is: Als je het vergelijkt met mensen in een hotel: fermionen willen een kamer voor zich alleen, bosonen willen samen in één kamer. |
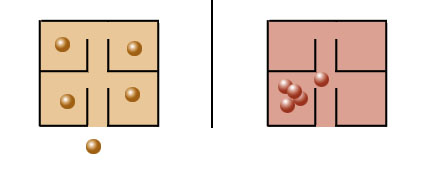
|
Fermionen willen apart | Bosonen willen samen |
|
| Deeltjesnamen |
|